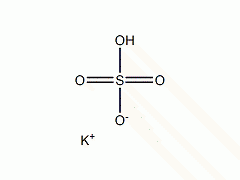
理化特性
主要成分:
外观与性状:无色单斜晶体,易潮解。
熔点(℃):197
沸点(℃):(分解)
相对密度(水=1):2.245
溶解性:易溶于水,不溶于乙醇、丙酮。
主要用途:用作食物防腐剂、分析试剂等。
其它理化性质:1.480
稳定性
禁配物:强氧化剂、强碱。
毒理学
急性毒性:LD50:2340 mg/kg(大鼠经口)
毒性作用:详细的毒副作用没有报告以外的其它致死剂量值。
生态学
其它有害作用:该物质对环境有危害,应特别注意对水体的污染。
废弃处置
废弃物性质:
废弃处置方法:在污水处理厂处理和中和。用石灰浆清洗倒空的容器。若可能,重复使用容器或在规定场所掩埋。
理化性质
硫酸氢钾(化学式:KHSO4)是钾的硫酸氢盐。硫酸氢钾溶于水发生电离,生成K+、H+、SO4 2-. 自然界中以罕见的重钾矾和纤重钾矾存在。它属于酸式盐,酸性很强,一般在红酒工业和分析化学中用作酸性试剂。水溶液与硫酸钾和硫酸混合溶液类似,若与乙醇混合,则沉淀出不溶的硫酸钾:
2KHSO4==乙醇==K2SO4↓+H2SO4
硫酸氢钾的水溶液显酸性,1mol/L溶液的pH大约为1.4。在某些情况下,硫酸氢钾的溶液可以代替39.0-42.0%的硫酸溶液使用。比如,蒸馏硫酸氢钾和乙酸钾的混合溶液可以得到乙酸,硫酸氢钾溶液也可以与大部分的碳酸盐反应并生成二氧化碳。
在一定程度上,硫酸氢钾表现出硫酸和硫酸钾混合物的性质。
硫酸氢钾可通过两种方法获得。
混合等物质的量的氢氧化钾和硫酸,可以得到硫酸氢钾和水。KOH + H2SO4 → KHSO4 + H2O氯化钾和硫酸可在高温下反应,生成硫酸氢钾和氯化氢气体。KCl + H2SO4 → KHSO4 + HCl 液态的硫酸氢钾会被喷洒到空中,在空中它冷却并凝固成固态的硫酸氢钾颗粒。副产物氯化氢可以溶解在水中而形成盐酸。
安全信息
危险性
危险性类别:腐蚀品
侵入途径:
健康危害:吸入、摄入或经皮吸收有害。对眼睛、皮肤和粘膜有强烈刺激和腐蚀性。吸入可引起喉、支气管炎、肺炎、肺水肿。接触后引起头痛、恶心、呕吐、咳嗽等。
环境危害:对环境有危害,对水体可造成污染。
燃爆危险:该品不燃,具腐蚀性、强酸性、强刺激性,可致人体灼伤。
急救措施
皮肤接触:立即脱去污染的衣着,用大量流动清水冲洗至少15分钟。就医。
眼睛接触:立即提起眼睑,用大量流动清水或生理盐水彻底冲洗至少15分钟。就医。
吸入:迅速脱离现场至空气新鲜处。保持呼吸道通畅。如呼吸困难,给输氧。如呼吸停止,立即进行人工呼吸。就医。
食入:用水漱口,给饮牛奶或蛋清。就医。
消防措施
危险特性:本身不能燃烧。受高热分解放出有毒的气体。具有腐蚀性。
有害燃烧产物:氧化硫、氧化钾。
灭火方法:消防人员必须穿全身防火防毒服,在上风向灭火。灭火时尽可能将容器从火场移至空旷处。然后根据着火原因选择适当灭火剂灭火。
应急处理
应急处理:隔离泄漏污染区,限制出入。建议应急处理人员戴防尘口罩,穿防酸服。不要直接接触泄漏物。小量泄漏:避免扬尘,小心扫起,收集于干燥、洁净、有盖的容器中。大量泄漏:收集回收或运至废物处理场所处置。
接触控制
监测方法:
工程控制:严加密闭,提供充分的局部排风。
呼吸系统防护:可能接触其粉尘时,必须佩戴防尘面具(全面罩)。紧急事态抢救或撤离时,应该佩戴空气呼吸器。
眼睛防护:呼吸系统防护中已作防护。
身体防护:穿橡胶耐酸碱服。
手防护:戴橡胶耐酸碱手套。
其他防护:工作现场禁止吸烟、进食和饮水。工作完毕,淋浴更衣。保持良好的卫生习惯。
合成方法
1.将87g K2SO4与27mL浓H2SO4(相对密度1.84)置于铂皿中混合,小心加热,直至反应物变得完全透明。将反应物的熔融体倒入置于冷水中冷却的瓷制或铂制的容器中,物料固化后,将其捣碎,移入密闭瓶中保存。
2. 用40kg蒸馏水溶解50kg工业碳酸钾,边加热边搅拌,溶解后用三层滤纸滤去不溶杂质。在搅拌下慢慢将工业硫酸加到清亮滤液中,进行反应。
当溶液ph为5~6时,停止加酸,静置。沉淀完全后,过滤,离心甩干,用蒸馏水洗至犆 犾 -离子含量合格。按每10kf硫酸钾加水7.5kg的量加入适量蒸馏水,搅拌下慢慢加入分析纯硫酸 ( 每10kg硫酸钾加9kg硫酸) ,通蒸汽加热使之全部溶解。
加入少许洗净的活性炭,加热搅拌片刻,趁热减压过滤。将清亮透明的滤液在80~100℃加热蒸发 ( 蒸发时防止暴沸) ,当密度为1.65~1.68时停止加热,自然冷却结晶,待结晶完全时 ( 约25 ~30℃) ,取出甩干,于100℃烘箱内烘干即可。
用途
1. 用作食物防腐剂、化学试剂等。
2. 用作分析试剂、防腐剂、分析硅时用作熔剂。
3.用作作酸性熔剂,分解结晶氧化铝、氧化铁等。还用作防腐剂,用于钾盐制备。